La L-arginina y algunos metabolitos, son esenciales en varias funciones fisiológicas y metabólicas. La suplementación de arginina en pacientes con enfermedades inflamatorias, traumas o tumores, puede ayudar a mantener funciones fisiológicas normales. La arginina puede mediar esta acción biológica en vías de oxido dependientes y oxido independientes del nitrógeno. También puede regular la homeostasis de cuerpos nítricos siguiendo una regulación hepática de la síntesis del N-acetyl glutamato (NAG) y la ureagenesis.
El hígado es el sitio para el metabolismo dietético de la arginasa. Entonces la identificación en el hígado de la velocidad de suplementación de la arginina puede ayudar a comprender el rol de este aminoácido en la regulación del NAG y la síntesis de la urea tan bien como en estado normal y anormal. Estudios anteriores sugieren que no hay un equilibrio directo entre la arginina de la dieta y la formada en el ciclo de la urea.
La arginina puede ser sintetizada en cuatro grupos enzimáticos: la arginasa, la oxido-nítrico sintasa, la arginina-glicina amidinotransferasa y la arginina descarboxilasa. La ornitina es el intermediario clave en la síntesis de la urea. Entonces el catabolismo de arginina vía arginasa puede regular la síntesis de urea por medio de la producción de ornitina para la síntesis de citrulina en la matriz mitocondrial. La isozima arginasa II se encuentra en la mitocondria y puede estar involucrada en la síntesis de ornitina, glutamato y poliaminas. Los autores del artículo usaron [U15 N4] arginina como precursor y cromatografía de espectrometría de masas para determinar si:
1.- El tiempo claro del catabolismo de la arginina N15 marcada en mitocondrias aisladas y consecuentemente la incorporación de N15 en glutamato, aspartato, citrulina y NAG. 2.- La dependencia de los metabolitos N marcados en la producción de la concentración de arginina. 3.- La producción de metabolitos N marcados e isotomeros de urea por hepatocidos periportales o hepatocidos perivenous.
Los resultados obtenidos muestran que en mitocondrias aisladas y fusiones de hígado, la ornitina, glutamato, citrulina, NAG N marcadas y urea fueron formados de arginina marcada externa.
Caracterización de la arginasa unida a la mitocondria.
La serie de experimentos iníciales fueron designados para determinar la actividad de arginasa en fracciones submitocondriales. Los resultados fueron los siguientes.
-Mitocondria lavada con KCL: 11.4 nmol/min/mg proteína
-Mitocondria no lavada: 94 nmol/min/mg proteína
-Matriz mitocondrial de mitocondria lavada con KCL: 7.1 nmol/min/mg proteína
-KCL contenido en el sobrenadante: 87 nmol/min/mg proteína
Catabolismo mitocondrial de la arginasa unida a la mitocondria.
En la figura 2, se observa que la porción no lavada presenta un mayor catabolismo de [U-15N] arginina. Y que la velocidad del catabolismo de la arginina marcada lavada y no lavada fue semejante a 0.08.
La producción de urea N-marcada y ornitina fue inversamente proporcional a la desaparición de la arginina N-marcada, por lo que podemos concluir que esta es la vía que sigue la arginina en el metabolismo. Además en la mitocondria que fue lavada con KCl, la producción de urea y ornitina aumenta linealmente en el curso de la incubación. En cambio en la que no fue lavada, estos productos incrementan linealmente solo entre 7 y 10 min, pero despues de los 10 min y hasta los 30 min, no se observan cambios representativos.
La tabla no. 1 nos indica que el catabolismo de la arginina marcada fue regenerado en un 60-70% como ornitina, glutamato, citrulina, aspartato y NAG. En ambas fracciones tanto las lavadas como las no lavadas con KCl.
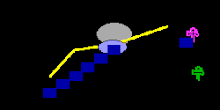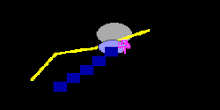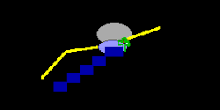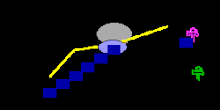
En la figura 1 se ilustró que la citrulina puede haberse formado de la ornitina y del carbamil fosfato que no fue marcado vía la ornitina transcarbamilasa y el glutamato fue transaminado a la forma de aspartato. Estos datos indican un rápido equilibrio entre el glutamato y el aspartato. La producción de aspartato en mitocondria y la translocación dentro del citosol puede servir como una fuente mayor para la síntesis de arginino succinato. (fig. 3B)
El glutamato generado de la ornitina también fue usado para la síntesis de el NAG por la N-acetil glutamato sintetasa mitocondrial (fig. 3C) En la mitocondria lavada con KCl, la producción de NAG muestra un periodo lag de entre 5 y 7 min y luego incrementa linealmente entre 10 y 20 min.
En ambas fracciones, lavada y no lavada la producción de NAG fue linealmente correlacionada a la producción de glutamato (fig. 3A) y esto indica una dependencia de la síntesis de NAG en la mitocondria. La figura 3D nos muestra una cinética semejante en la producción de citrulina.
Para demostrar que la producción de los metabolitos esta mediada por la presencia de arginina, se realizaron experimentos en donde se determino la dependencia de la producción de estos en presencia de distintas concentraciones de arginina N-marcada. En la figura 4ª se muestra la producción de glutamato y a como habíamos visto anteriormente la producción es mayor en la fracción no lavada que en la lavada, pero en ambas se observa un aumento considerable en presencia de arginina, comparando cuando no esta presente y en concentración de 1mM, sin embargo estos resultados pueden no ser muy convincentes ya que las desviaciones estándar son demasiado grandes. En la figura B, la concentración de aspartato, es mucho mayor en la fracción no lavada y también muestra una activación mayor en presencia de arginina. La figura D, para el N-acetil glutamato también muestra un efecto parecido igual que en los anteriores. Y la figura D, nos sorprende un poco, ya que la producción de citrulina, presenta la misma curva con muy poca diferencia entre las fracciones lavada y no lavada, pero es muy marcada en ambas la activación en presencia de arginina.
Las figuras 5 y 6 nos muestras un comportamiento parecido a lo descrito anteriormente, pero la diferencia es notable ya que aquí se utiliza amonio con dos marcaciones distintas, esto nos demuestra que existe una interconvercion entre los distintos tipos de metabolitos y sus precursores y que la ausencia o presencia de estos, es mediada por los requerimientos a los que esta expuesta la célula.
Y para terminar, los autores realizan un enriquecimiento isotópico con los metabolitos N-marcados. La figura A muestra el enriquecimiento en hígado con una perfusión de 0.25 nM [U-N15] arginina y 0.3 mM NH4Cl; y el inciso B muestra lo mismo pero con 1 mM de glutamina no marcada. Los resultados muestran que existe un mayor enriquecimiento a como era de esperarse para la arginina, ya que es la base que se utilizo. También observamos un enriquecimiento muy parecido entre la ornitina y la citrulina en ambas preparaciones, que coinciden con los experimentos realizados anteriormente. Y un bajo enriquecimiento para el glutamato, aspartato y el NAG.
En resumen, este trabajo proporciona una amplia evidencia para la hipótesis de que la arginina estimula la ureagenesis secundaria y que este metabolismo es llevado a cabo por la vía intramitocondrial de la arginasa. También soporta que esta suple a la ornitina en la síntesis de la citrulina, glutamato, NAG y aspartato. Se encontró que la arginina sirve para futuros sustratos del NAG, citrulina y aspartato, dando un mecanismo adicional por el cual la arginina puede estimular la síntesis del NAG y entonces regular la ureagénesis.
Figura 1. Vía metabólica del catabolismo de la arginina en el citosol y en la mitocondria, y su acoplamiento en la ureagénesis.